Joe Demayo wusste immer, dass seine gesunden Jahre abrupt enden konnten und an die Lebensdauer einer transplantierten Niere über die Größe einer kleinen Faust gebunden waren. Aber als Vater eines Kleinkindes hatte er gehofft, mehr Zeit zu haben.
Als er 33 Jahre alt war, hatte seine Frau ihm ihre Niere gespendet, einen Meilenstein, der den Verlauf von Demayos Leben veränderte. Die unerbittliche Müdigkeit, die Nasenbluten und die juckende Haut, die von seinen eigenen schlecht funktionierenden Nieren hervorgerufen wurde, verschwand, und er fühlte sich gut genug, um das Haus in Philadelphia für einen Neuanfang in den Ausläufern Nordkaliforniens zu verlassen.
Über lange Nachmittage wanderte Demayo mit seiner Frau und ihrem Schwarz-Weiß-Köter Fausto in die Berge. Als sein Sohn geboren wurde, hatte er sich vorgestellt, Baseballspiele zu trainieren, die mit Phillies Gear verkleidet waren.
Aber seine gespendete Niere begann Anfang 2023 zu scheitern, viel früher als erwartet. Der Niedergang überraschte Demayo, der seine Medikamente treu eingenommen hatte, darunter Tacrolimus, ein wesentliches Immunsuppressions -Medikament, das die Ablehnung der Organ abnimmt.

Kredit:
Mit freundlicher Genehmigung von Joe Demayo
Demayo wusste zu der Zeit nicht, dass die Kapseln, die er zweimal am Tag, genau 12 Stunden voneinander entfernt, geschluckt hatte, ihn verletzlich zu machen haben – oder dass einer der beeindruckendsten Drogenregulierungsbehörden der Welt möglicherweise nicht geschafft hat, ihn zu schützen.
Als er schwächer wurde, fuhr seine Niere nicht in der Lage, seinen Körper von überschüssigen Flüssigkeit und Verschwendung zu reinigen, und die Ermittler der Food and Drug Administration fuhren nach Westindien, um die Fabrik zu inspizieren, die Demayos Tacrolimus und andere Generika für amerikanische Verbraucher herstellte.
Es war zumindest zum achten Mal seit 2015, dass die FDA dort gewesen war, und jeder dieser Besuche hatte Probleme in der Art und Weise, wie die Medikamente gemacht wurden, aufgedeckt, wie die Regierungsunterlagen belegen.
Während der Inspektion im Frühjahr 2023 stellten die Ermittler fest, dass die Fabrik der Intas Pharmaceuticals unter anderem die Aufzeichnungen über Drogentests manipulierte, um das Vorhandensein von Partikeln zu vertuschen-zu denen auch Glas, Ballaststoffe oder andere Verunreinigungen gehören könnten-in den Arzneimitteln des Unternehmens.
Demayo war sich der Inspektion nicht bewusst und nahm seine Tacrolimus -Kapseln weiter. Er kämpfte gegen Erschöpfung und kämpfte darum, seinen Job hinter einem Deli -Schalter festzuhalten.
“Daddy braucht eine neue Niere”, erinnerte er sich, dass er seinem 5-jährigen Sohn damals erzählte.
Kredit:
George Etheredge, Spezial für ProPublica
Im November verbot die FDA die Intas -Fabrik, Drogen in die Vereinigten Staaten zu exportieren. In einer langjährigen Praxis, die von ProPublica aufgedeckt wurde
In einer Erklärung gegenüber ProPublica erklärte Intas, deren US -Tochtergesundheit im Gesundheitswesen übereinstimmt, dass das Unternehmen die Fälle einzelner Patienten nicht kommentieren könne, sondern dass sein Tacrolimus sicher und wirksam ist. Das Unternehmen sagte, es reagierte sofort auf die Inspektionsergebnisse der FDA und startete ein Programm, das sich auf Qualität konzentrierte und Millionen von Dollar in Upgrades und neue Mitarbeiter investiert. Intas sagte auch, dass einige ausgenommene Drogen niemals in die USA verschifft wurden, aber keine Details liefern würden.
“Intas ist auf dem besten Weg zur vollständigen Sanierung aller Produktionsstätten”, sagte das Unternehmen.
Die Untersuchung von ProPublica ergab, dass die FDA in den letzten Dutzend Jahren mehr als 150 Medikamente oder ihre Zutaten von verbotenen Fabriken in das Land ermöglicht hat, angeblich zur Vorbeugung von Drogenmangel.
Die Agentur testete die Medikamente nicht routinemäßig und suchte aktiv nach Anzeichen von plötzlichen oder unerklärlichen Reaktionen bei Patienten. Und die Ausnahmen wurden weitgehend vor dem Kongress und der Öffentlichkeit verborgen, einschließlich Patienten wie Demayo, die sich auf seine Medikamente zählten, um ihn am Leben zu erhalten.
Demayo füllte ein weiteres Rezept für Tacrolimus nur wenige Tage, bevor die FDA es vom Intas -Importverbot ausnahm, und nahm die Kapseln bis kurz vor seiner zweiten Transplantation des Temple University Hospital im Januar 2024 weiter.
“Ich versuche das Richtige zu tun, alle meine Medikamente zu nehmen”, sagte Demayo, 45, der Intas Tacrolimus zwei Jahre lang nahm. “Wenn ich das alles mache, sollte nicht jemand seine Due Diligence machen?”
In einer Erklärung sagte die FDA, Drogenhersteller, die einen Pass von Importverboten erhalten, müssen zusätzliche Sicherheits- und Qualitätstests durchführen und Experten von Drittanbietern einstellen, um die Ergebnisse zu bewerten, bevor Medikamente in die USA versendet werden. Aktuelle und ehemalige FDA -Beamte sagten, diese Maßnahmen seien fehlerhaft. Viele der Unternehmen wurden bereits zum Testen von Protokollen zitiert, die ineffektiv oder anfällig für Betrug waren.
Demayo, der jetzt von seiner zweiten Transplantationschirurgie geborgen wurde, gab ProPublica zwei Flaschen seiner nicht verwendeten Intas Tacrolimus -Kapseln. ProPublica hatte sie in Valisure testen, einem unabhängigen, akkreditierten Labor in Connecticut.
In ihrem ersten Test stellten die Wissenschaftler von Valisure fest, dass einige der Pillen von Demayo eine angemessene Menge an den wichtigsten Bestandteilen enthielten, andere jedoch eine niedrigere Menge als das von der US -Verordnung festgelegte Mindestniveau enthielten. Apotheker, Ärzte und andere Experten sagten, dass Unterdosierung die Patienten für die Ablehnung des Organs anfällig machen können.
Valisure fand keine materielle Kontamination in Demayos Medikamenten.
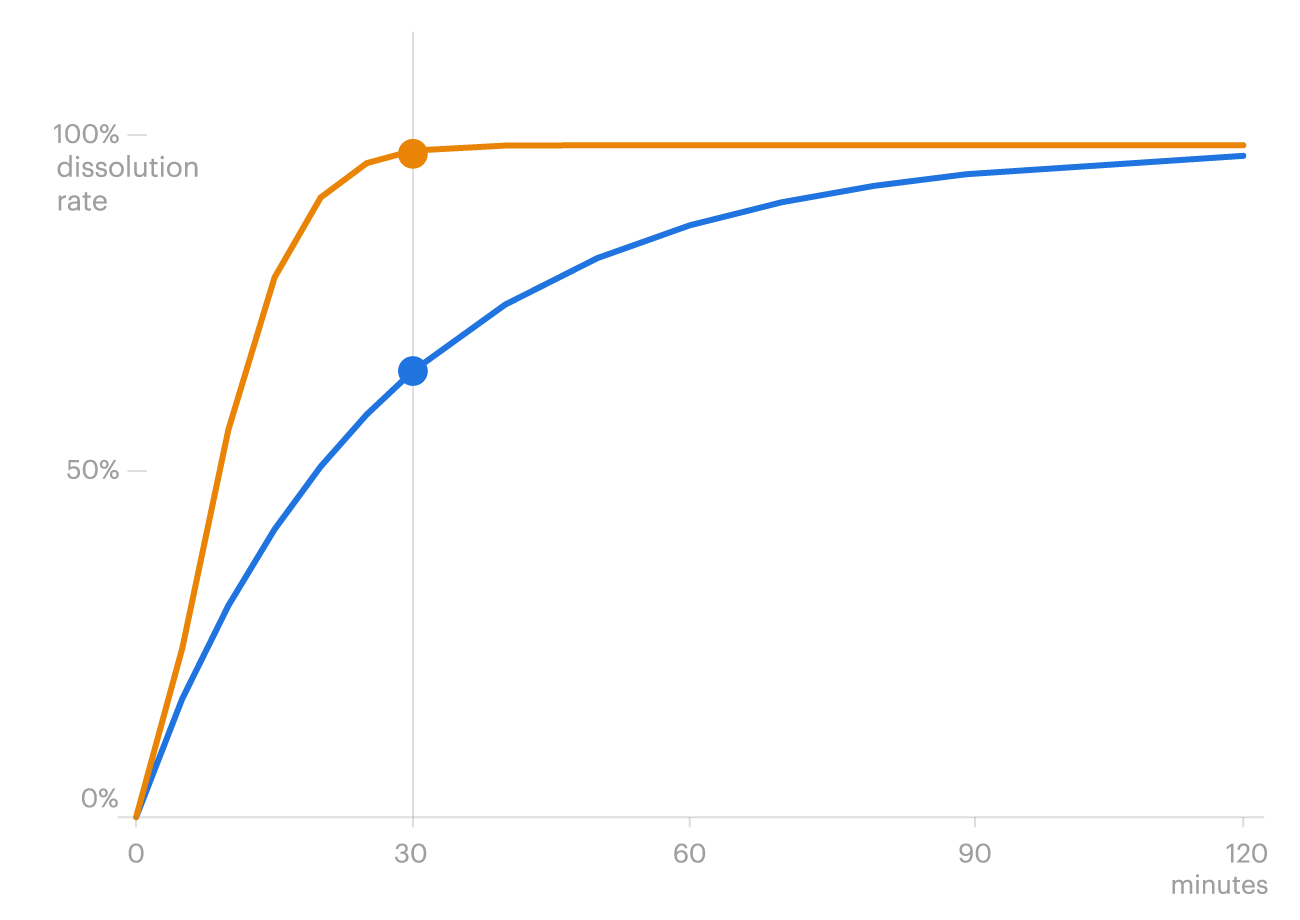
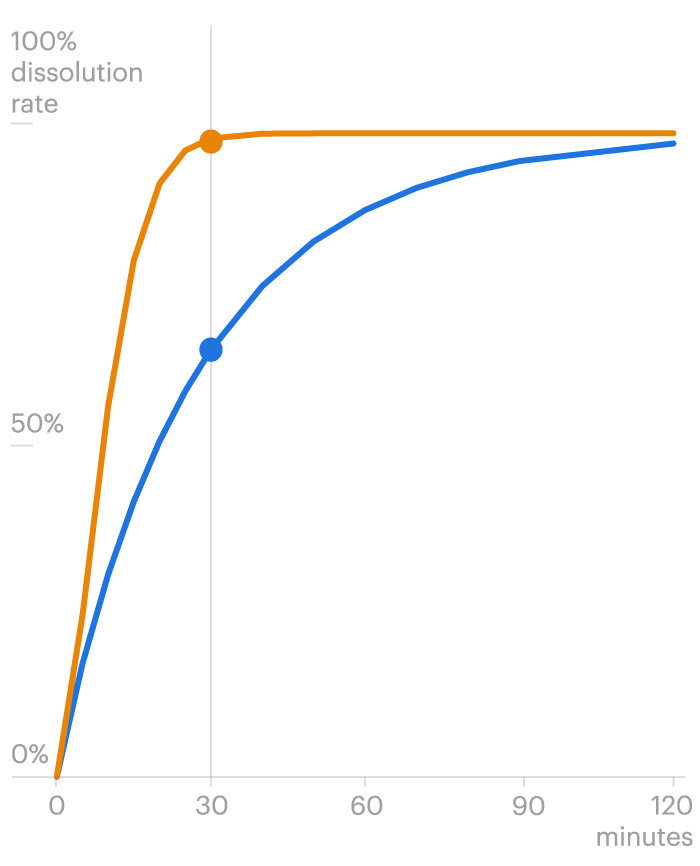
Aber die Wissenschaftler fanden ein weiteres potenzielles Problem. Die Kapseln lösten sich schnell auf – bis zu dreimal schneller als die Marke. Eine schnelle Auflösung kann zu schnell zu viel von der Droge einführen, so Experten, und verursachen möglicherweise Zittern, Kopfschmerzen und Nierenversagen.
ProPublica hat Tacrolimus von keinem anderen Hersteller getestet. In seiner Aussage sagte Intas, dass die Ergebnisse „nicht mit dem zu tun haben [FDA’s] Inspektionen “und dass die FDA festgestellt hatte, dass das Medikament der Markennamenversion entspricht, als es zum ersten Mal für den US-Markt zugelassen wurde.
Valisure zuvor getestet Intas 'Tacrolimus für das Verteidigungsministerium, das Sicherheits- und Qualitätstests an mehr als drei Dutzend Medikamenten durchführt, die üblicherweise von US -amerikanischen Servicemitgliedern und ihren Familien verwendet werden. Auch diese Tests zeigten, dass die Kapseln zu schnell aufgelöst wurden.
“Dies ist ein alarmierendes Signal für andere Qualitätsprobleme, die sich auf die Patientenversorgung auswirken können”, sagte Vic Suarez, Col. Col. Vic Suarez, der pensionierte Armee, der bei der Start des Verteidigungsministeriums beigetragen hat und das Projekt unterstützt.
Die FDA führte in den letzten Jahren ihre eigenen Studien zum Tacrolimus von Intas durch und berichtete auf seiner Website über ein ähnliches Ergebnis. Die Agentur stellte fest, dass es kein offensichtliches Risiko für die Ablehnung des Organs gab, sagte jedoch, dass der Intas Generic Toxine im Körper schaffen könne, was Nierenschäden verursachen kann. Die FDA sagte, die Kapseln liefern möglicherweise nicht den gleichen therapeutischen Effekt wie die Markenversion.
Die Ergebnisse wurden im September 2023 veröffentlicht. Wochen später entschuldigte die Agentur das Medikament aus dem Intas -Importverbot, sodass das Unternehmen Tacrolimus weiter in die USA versandt.
Janet Woodcock, der jahrelang das FDA -Zentrum für Drogenbewertung und -forschung leitete, sagte in einem Interview, dass die Ergebnisse der Tests besorgniserregend sind und dass die Agentur schnell „versuchen sollte, sie auszulöschen“.
“Dies war offensichtlich ein Qualitätsproblem”, sagte sie.
Woodcock sagte nicht, warum die FDA das Medikament von dem im Intas Factory auferlegten Einfuhrverbot befreit hatte. Obwohl Woodcock jahrelang Ausnahmen genehmigte, hatte sie das Zentrum verlassen und diente als stellvertretende Kommissarin der FDA, als die Ausnahmen für Tacrolimus und andere Intas -Medikamente vorgenommen wurden.
Demayo sagte, er werde nie wissen, ob das Medikament zum Verlust seiner gespendeten Niere beigetragen hat. Die Ablehnung des Organs, die schnell oder über Jahre eintreten kann, gehört zu den häufigsten Ursachen für Nierenversagen bei Transplantationspatienten, aber Nieren können auch aus anderen Gründen scheitern, sagte Joseph Vassalotti, Chief Medical Officer bei der National Nidney Foundation.
In Demayos Fall wurde er mit einem Magenvirus und einer Dehydration im selben Jahr ins Krankenhaus eingeliefert, in dem seine Nierenfunktion abnahm. Trotzdem stellt er das Medikament in Frage, das ihn schützen sollte, und befürchtet, dass andere Transplantationspatienten, die Intas Tacrolimus eingenommen haben, gefährdet sein könnten.
Eineinhalb Jahre nachdem die FDA die Fabrik von Versandmedikamenten in die USA verboten hat, ist Tacrolimus immer noch ausgeschlossen. Ein Kundendienstmitarbeiter des Unternehmens sagte, Intas habe kürzlich eingestellt, das Medikament zu verteilen, das Unternehmen habe jedoch nicht auf eine Anfrage nach Kommentaren geantwortet.
“Die Menschen, die die Pillen überwachen, scheitern und die Menschen, die die Pillen herstellen, scheitern”, sagte Demayo. “Wie ist es so schlimm geworden?”
Kredit:
Erste und dritte Fotos: Hannah Yoon für ProPublica. Zweites Foto: George Etheredge, Spezial für ProPublica.
Lucas Waldron hat Grafiken und Entwicklung beigetragen.
#Nach #seiner #Nierentransplantation #nahm #Tacrolimus #aus #einer #von #der #FDA #investigten #FabrikProPublica