Le sénateur Bill Cassidy (R-La.) a publié un nouveau rapport sur la modernisation de la FDA. Il a du bon matériel.
…Le processus d’examen des nouveaux produits par la FDA peut être une « boîte noire » imprévisible. Les équipes de la FDA peuvent varier considérablement dans la mesure dans laquelle elles exigent des tests ou imposent des normes qui ne sont pas alignées sur les risques pertinents. Le décalage perçu entre la rhétorique et la réflexion prospectives des hauts responsables de la FDA et la pratique prudente des évaluateurs crée une imprévisibilité supplémentaire. Cette incertitude freine les investissements et augmente le temps nécessaire aux patients pour recevoir de nouveaux traitements.
Les entreprises signalent qu’elles sont confrontées à une « loterie des révisions », où les questions cruciales dépendent de l’approche d’un petit nombre de personnes à la FDA. Certaines équipes d'examen de la FDA sont créatives et avant-gardistes, aidant les développeurs à concevoir des programmes et à surmonter les obstacles pour proposer aux patients les produits dont ils ont besoin sans lésiner sur les raccourcis. Par exemple, le Centre d'excellence en oncologie (OCE) de la FDA est régulièrement identifié comme un modèle offrant des options prévisibles mais flexibles pour fournir de nouveaux médicaments aux patients atteints de cancer. L'OCE est désormais un paradigme réglementaire basé sur le dialogue qui a facilité les efforts du monde universitaire, de l'industrie, des National Institutes of Health (NIH) et d'autres pour développer de nouvelles thérapies contre le cancer et lancer des programmes et des projets pilotes innovants tels que le projet Orbis et RealTime Oncology Review.
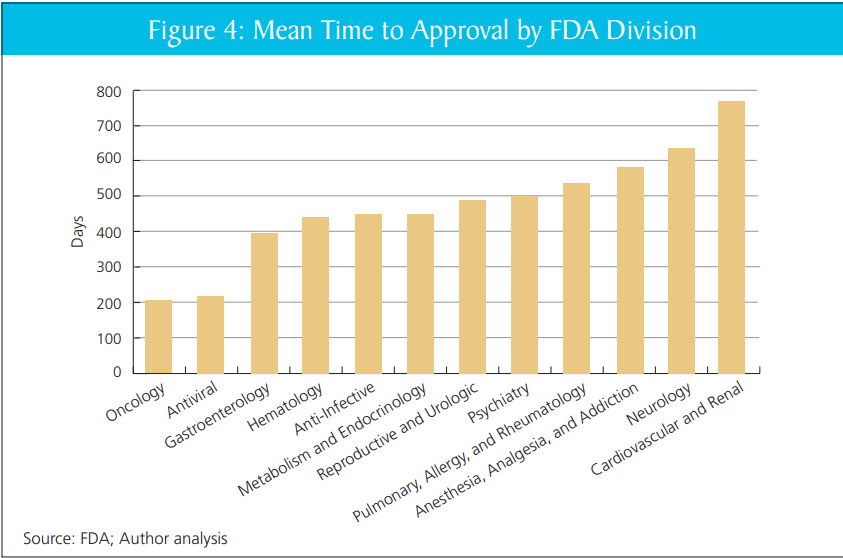
C'est tout à fait exact. Dans mon rapport avec DiMasi et Milne, nous montrons que les délais d'examen varient considérablement au sein de la FDA et entre les départements sans raison claire. Laissant de côté les grandes questions de « FDA ou pas de FDA », l’expansion des pratiques des départements les plus performants générerait probablement de gros gains.

Mike Doherty continue de demander à l'IA ce qu'Alex Tabarrok penserait du rapport Cassidy. Il répond :
Caractéristiques les plus fortes : Il diagnostique correctement la FDA comme un goulot d'étranglement à l'innovation, met l'accent sur les preuves « les moins lourdes », appelle à des voies rationalisées (produits biologiques de type 505(b)(2), simplification des biosimilaires) et craint que les États-Unis puissent perdre des essais précoces au profit d'autres pays. C'est clairement la responsabilité de Tabarrok : la réglementation comme taxe cachée sur l'innovation et la croissance.
Caractéristiques les plus faibles : les compromis sont rarement quantifiés, presque jamais confrontés au « cimetière invisible » des patients qui ne voient jamais de thérapies en raison de retards, et les réformes sont traitées comme des ajustements mineurs plutôt que comme des tests de modèles réglementaires fondamentalement différents (par exemple, approbation basée sur l'assurance, certification privée ou expiration/expérimentation de régimes parallèles).
Si vous considérez cela comme un projet de note remis à Tabarrok, il dirait probablement : « Bonne direction ; ajoutez maintenant 50 % de plus d'économie, 50 % de plus de quantification et 100 % plus de volonté d'expérimenter la concurrence institutionnelle. »
Oui, plutôt bien.
Addenda: Dans d'autres actualités de la FDA, voir aussi Adam Kroetsch sur « Will Bayesian Statistics Transform Trials ?
Addendum 2: La FDA a désormais accepté de réexaminer le vaccin contre la grippe de Moderna, ce qui est une bonne chose, même si le revirement de situation indique évidemment l'imprévisibilité de la FDA.
L'article « Le rapport Cassidy sur la FDA » est apparu en premier sur Marginal REVOLUTION.
#rapport #Cassidy #sur #FDA



