
Les inspecteurs américains ont découvert un effondrement nouveau et dangereux de la production de médicaments dans une usine indienne par Sun Pharma qui produit des médicaments génériques pour les consommateurs américains.
Les problèmes récents surviennent 2 ans et demi après que la Food and Drug Administration de l'établissement a donné un laissez-passer spécial pour envoyer certains médicaments plus loin aux États-Unis, même après que l'usine a été officiellement exclue du marché américain.
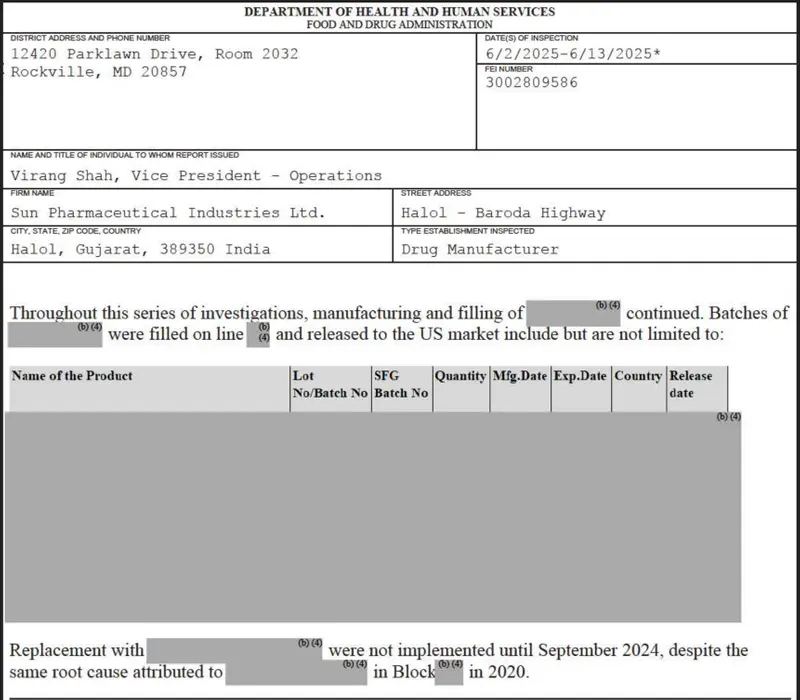
L'usine n'a pas pu examiner la source bactérienne trouvée dans les bouteilles d'essai ou traiter avec des dispositifs endommagés qui avaient provoqué des médicaments contaminés par des particules métalliques. Cela vient du rapport d'inspection en juin, que Prublica avait reçu par une demande de la Freedom of Information Act.
Les travailleurs n'ont pas correctement agi avec des bouteilles et des bouchons qui sont destinés aux médicaments stériles, et dans certains cas, les zones de production et l'équipement n'ont pas pu se désinfecter, selon le rapport. Un inspecteur de la FDA a vu un travailleur mettre une robe stérile, puis a mis à niveau contre un conteneur de déchets et a poussé les ordures bondées avec ses mains. Les enquêteurs ont également vu comment les liquides à travers les déchirures du plafond et la croissance des champignons et des moisissures apparemment dans une zone de stockage pour des échantillons pour tester les gouttes.
À la fin de 2022, la FDA avait interdit l'usine dans la ville de Halol en raison d'une défaillance de production similaire des médicaments des navires aux États-Unis.
ProPublica a rapporté le mois dernier qu'un groupe à faible profil au sein de l'agence avait également exclu certains médicaments de cette interdiction, censé éviter les lacunes. La FDA a accordé des exceptions similaires à des médicaments qui ont été produits dans plus de 20 autres usines étrangères qui ont violé les normes critiques de la production de médicaments et exclues du marché américain.
La FDA a gardé la pratique cachée au public. L'agence n'a pas régulièrement testé des médicaments qui proviennent des usines interdites ou qui ont suivi de manière proactive les rapports sur les dommages possibles aux consommateurs, a déclaré Publica.
Dans le cas du Soleil, plus d'une douzaine de médicaments de l'interdiction d'importation de Halol ont été exclus. L'entreprise peut encore en envoyer cinq aux États-Unis, comme enregistrements d'État, notamment Vecuronium Bromid, un relaxant musculaire qui est utilisé pendant l'opération et le médicament contre la doxorubicine. LivalProex -Delay Les libertés qui traitent les convulsions et autres maladies sont également exclues. Leuprolidinjection, appliquée par des personnes atteintes d'un cancer de la prostate, de l'endométriose et d'autres maladies; et capsules de témozolomide pour le cancer du cerveau.
L'inspection du mois dernier a été pour la première fois que la FDA était de retour à l'usine au cours des 2,5 années depuis qu'il a imposé l'interdiction d'importation et le soleil a commencé à envoyer exclusivement des drogues aux États-Unis. Les inspecteurs ont constaté que les procédures de prévention de la contamination microbiologique des médicaments stériles n'étaient pas déterminées ou suivies et que les dispositifs n'ont pas été maintenus pour éviter des dysfonctionnements qui “modifieraient la sécurité, l'identité, la résistance, la qualité ou la pureté du produit médicamenteux”, indique le rapport.
Certaines des préoccupations se sont concentrées sur les drogues sauf qui étaient encore envoyées aux États-Unis, selon une personne qui connaissait la situation qui ne voulait pas être nommée parce qu'elles n'étaient pas justifiées de parler publiquement. La FDA a assombri les noms du médicament qui pourrait avoir été affecté dans leur rapport d'inspection publié publiquement, y compris un médicament sur une chaîne de production dans laquelle plusieurs lots devaient être rejetés parce qu'ils étaient remplis de particules noires.
Crédit:
Reçu de Publica
“Il est décevant de voir que des problèmes à cet endroit se produisent compte tenu du rôle de l'emplacement dans la production potentielle de médicaments critiques pour les consommateurs américains”, a déclaré la personne familière avec les résultats de l'inspection.
Sun n'a pas répondu aux questions sur la dernière inspection ou ses antécédents réglementaires à la FDA. Dans un montant électronique, la société a déclaré que la conformité aux normes de qualité «a une priorité absolue pour le soleil et que nous maintenons une orientation infatigable sur la qualité et la conformité afin d'assurer des soins ininterrompus avec des médicaments à nos clients et aux patients dans le monde.
La FDA a déclaré que les usines qui reçoivent les exceptions aux interdictions d'importation doivent effectuer des tests supplémentaires sur les médicaments avec la supervision des prestataires de tiers avant d'être envoyés aux États-Unis pour assurer la sécurité des patients. Cependant, les travaux de Sun Halol ont été répertoriés en 2022 et le mois dernier, car il n'a pas examiné de manière approfondie des problèmes de qualité, y compris les contaminants trouvés lors des tests de dépistage de médicaments. La FDA n'a pas répondu à une demande de commentaire sur la dernière autorité d'inspection solaire.
La représentante américaine Debbie Dingell, D-Michigan, qui a récemment parrainé une législation pour réduire les coûts des médicaments sur ordonnance, a déclaré à Publica que la FDA était chargée de veiller à ce que le médicament soit sécurisé.
“Nous avons besoin d'une transparence complète sur la mesure dans laquelle les exceptions des sous-acteurs, des médicaments dangereux ou inefficaces peuvent être distribués aux patients américains”, a-t-elle déclaré.
Katherine Dailey, étudiante en laboratoire d'enquête de Medill, a contribué aux rapports.
#nouvelle #inspection #FDA #trouve #des #informations #dans #une #usine #qui #délivre #des #médicaments #américains #Prublica




